オリゴ核酸・ペプチド原薬の
受託製造
Our Services
探索研究から医薬品原薬製造まで
オリゴ核酸原薬、ペプチド原薬の受託製造事業では、薬効・毒性評価を対象とした少量合成から、パイロット製造に向けたプロセス開発・試験法開発の受託研究、GMPに準拠した原薬製造まで、各ステージにおいてお客様のニーズにお応えします。
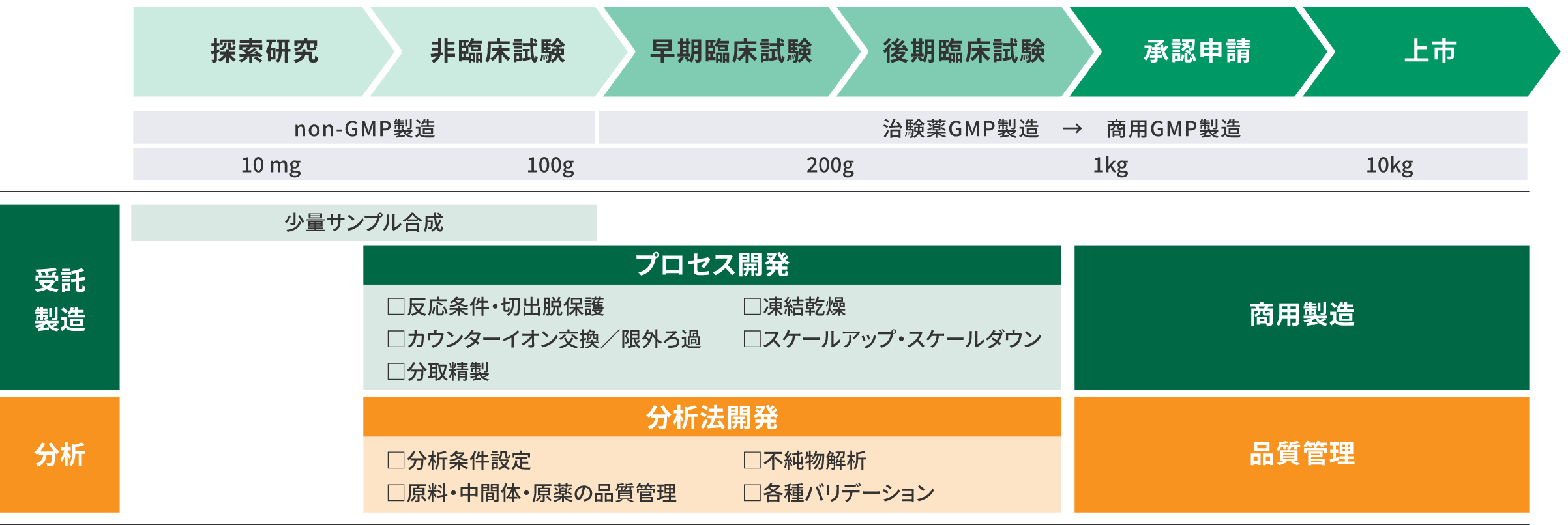
探索段階から非臨床ステージのサービスは合成ラボにて実施し、臨床、上市ステージのサービスはGMP施設で製造いたします。
独立した合成・精製の製造ラインを核酸は2系列、ペプチドは1系列有し、中分子原薬では日本国内有数の製造規模を誇ります。
- For lab scale
- AKTA Oligopilot Plus 100
- AKTA Pure 150/Avant 150
- Tangential flow filtration system → Flow rate: up to 2.9 L/min
- Lyophilizer → Ice holding capacity up to 3 L
- For manufacturing scale
- Oligopilot 400 x 2
- Low pressure purification system → Column diameter 100, 200 mm→ Flow rate: up to 5 L/min
- High pressure purification system → Column diameter 200, 450 mm → Flow rate: up to 3, 6 L/min
- Tangential flow filtration system → Flow rate: up to 2.9, 19 L/min
- Lyophilizer → Ice holding capacity up to 50 L
- Peptlde synthesizer(30L)
- For analysis
- UHPLC: Waters ACQUITY UPLC H-Class Bio
- Off-line 2D-LC: Thermo Fisher Scientific UltiMate 3000
- HRMS: Thermo Fisher Scientific Q Exactive
-

オリゴ核酸原薬の受託合成
-

ペプチド原薬の受託合成
品質保証
GMPを遵守し確かな品質の原薬を提供します
GMP(Good Manufacturing Practice)とは医薬品を製造する上で遵守が求められる製造管理、品質管理の基準です。
- <GMPの3原則>
- 人為的な誤りを最小限にすること
- 医薬品の汚染及び品質の低下を防止すること
- 高い品質を保証するシステムを設計すること
GMPに対応した手順書を作成し、継続した教育訓練を行うなど、一人ひとりが医薬品製造に携わる者として高い意識を持って業務にあたります。
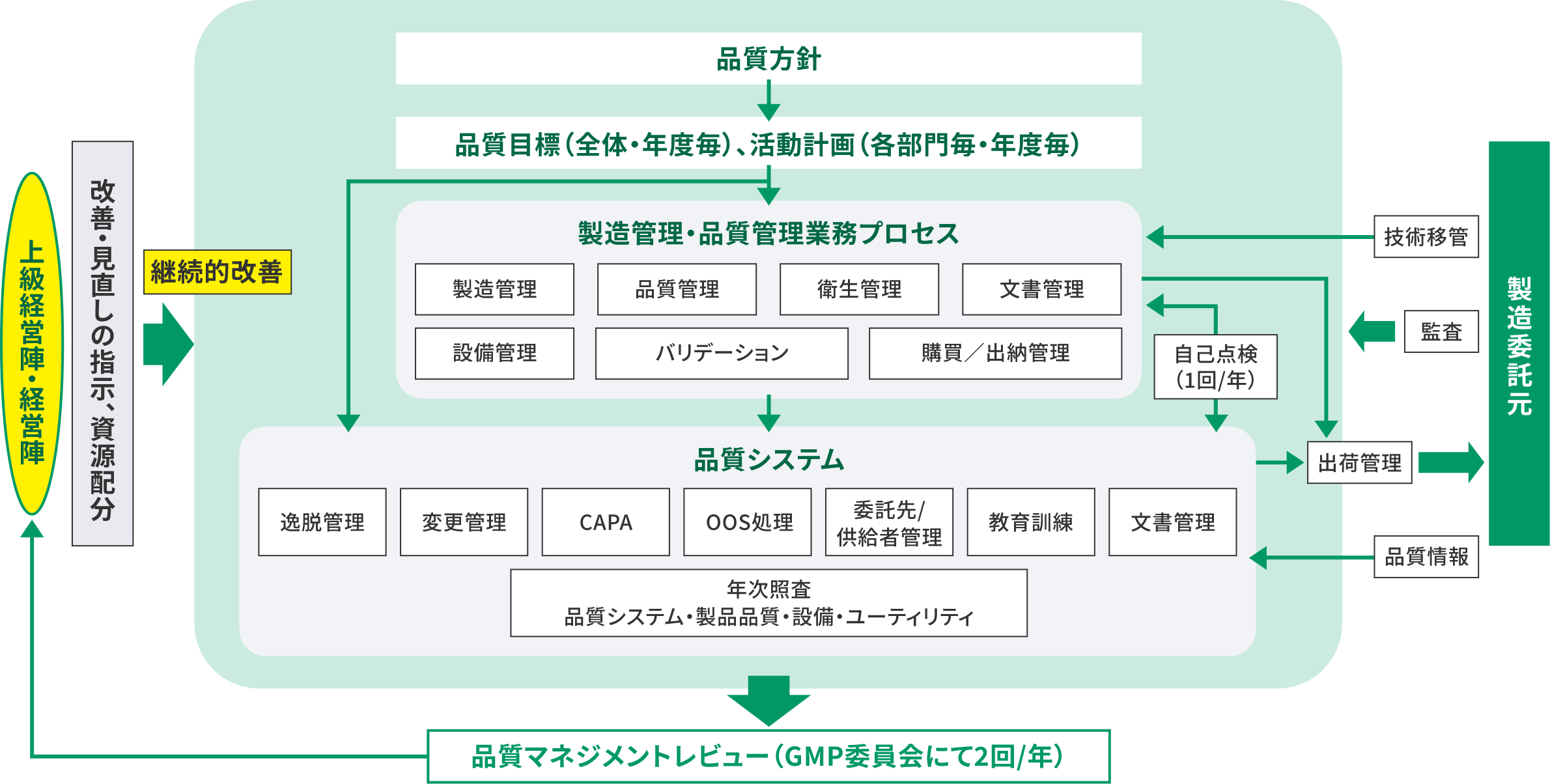
品質マネジメントシステム
品質方針・品質目標・達成プロセスを確立するために、医薬品で求められる品質マネジメントシステムを導入しています。品質方針に基づき、品質目標を年度毎に策定。GMP活動の結果は、年2回のGMP委員会にて、経営陣によるマネジメントレビューも実施、適切な品質を継続的にお届けします。
- 品質方針*
- ・顧客の信頼と満足を得る高品質の治験用原薬を提供します。
- ・治験用原薬の安定供給と品質向上のため継続的な改善を行います。
- *今後、医薬品製造業許可取得予定
- 私たちのデータインテグリティ
宣言 - 私たちは、医薬品開発に携わる者として、健康を願う患者さんのために一丸となってデータインテグリティ(データの完全性、一貫性、正確性)の確保に取り組みます。
TOPICS
1)クロスコンタミの防止
GMP施設の要件の一つとして、コンタミの防止が挙げられます。日本触媒のGMP施設の製造区域はISO class7(非作業時)を最高とする3段階の清浄度区分を設定しています。入退室用の更衣室・エアロック、物品搬入出用のパスルームの配置など、動線を適切に確保し、製造ライン及び清浄度区分に応じて設計された複数の空調系統の設置、清浄度区分間の差圧管理などにより、偶発的な異物混入や異種品の混入を排除しています。
2)安全性確保
社是「安全は生産に優先する」のもと、安全に製造を行うために、分解熱量測定、反応熱測定、化学工学シミュレーションを実施。防爆対応も徹底しています。




